
- English
- Español
- Português
- русский
- Français
- 日本語
- Deutsch
- tiếng Việt
- Italiano
- Nederlands
- ภาษาไทย
- Polski
- 한국어
- Svenska
- magyar
- Malay
- বাংলা ভাষার
- Dansk
- Suomi
- हिन्दी
- Pilipino
- Türkçe
- Gaeilge
- العربية
- Indonesia
- Norsk
- تمل
- český
- ελληνικά
- український
- Javanese
- فارسی
- தமிழ்
- తెలుగు
- नेपाली
- Burmese
- български
- ລາວ
- Latine
- Қазақша
- Euskal
- Azərbaycan
- Slovenský jazyk
- Македонски
- Lietuvos
- Eesti Keel
- Română
- Slovenski
- मराठी
- Srpski језик
Bosutinib CAS 380843-75-4
2023-08-21
Nom chimique:
4-(2,4-dichloro-5-méthoxyanilino)-6-méthoxy-7-[3-(4-méthylpipérazin-1-yl)propoxy]quinoléine-3-carbonitrile
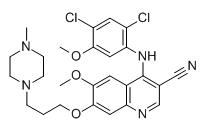
M.F :C26H29Cl2N5O3
Propriétés chimiques :Solide jaune pâle
Le bosutinib est un inhibiteur de la kinase Bcr-Abl destiné au traitement de la leucémie myéloïde chronique (LMC) à chromosome Philadelphie positif (Ph+). Comparé à d’autres inhibiteurs de la tyrosine kinase, il présente un profil de toxicité hématologique plus favorable. Approuvé par la FDA le 4 septembre 2012.
Innovateur:Wyeth Pharmaceuticals (Pfizer) (États-Unis)
Applications:
Des effets sur la morphologie cellulaire ont été observés à une concentration de 1 µM de SKI-606 pour toutes les lignées cellulaires examinées, et des changements morphologiques étaient apparents à des concentrations aussi faibles que 0,25 µM. SKI-606 a amené les cellules à adhérer les unes aux autres, formant des amas denses par rapport aux cellules traitées avec le véhicule témoin (DMSO), qui se sont propagées sur de plus grandes zones.
Forme galénique : Administration orale, 100 mg/Kg/j, pendant 28 jours
Intermédiaires :
N° CAS 2031-23-4 Dichlorhydrate de 1-(3-chloropropyl)-4-méthylpipérazine
No CAS : 214470-66-3 7-(3-chloropropoxy)-4-hydroxy-6-méthoxyquinoléine-3-carbonitrile
N° CAS 214470-68-5 4-CHLORO-7-(3-CHLORO-PROPOXY)-6-METHOXY-QUINOLINE-3-CARBONITRILE
N° CAS 263149-10-6 4-CHLORO-7-HYDROXY-6-METHOXY-QUINOLINE-3-CARBONITRILE
N° CAS 380844-49-5 7-(3-CHLORO-PROPOXY)-4-(2,4-DICHLORO-5-METHOXY-PHÉNYLAMINO)-6-METHOXY-QUINOLINE-3-CARBONITRILE
Le médicament ciblé Bsutinib (Bosulif) a été approuvé par la FOOD and Drug Administration (FDA) pour le traitement de la leucémie myéloïde chronique. Le bésutinib est un inhibiteur de kinase qui inhibe les voies de signalisation Abl et Src. Le médicament est destiné à traiter les patients adultes atteints de LMC à chromosome Philadelphie positif (Ph+) chroniques, accélérés ou aigus présentant une résistance ou une intolérance antérieure aux médicaments, selon une annonce de Pfizer Oncology. Environ un tiers des patients atteints de LMC ne répondent pas bien au traitement avec le médicament standard de première intention, le Gleevec, a déclaré Pfizer. Environ la moitié des patients qui développent une résistance ou une intolérance à l'imatinib répondent également mal aux autres inhibiteurs de la tyrosine kinase (ITK) de deuxième intention, a indiqué la société.
L'approbation du médicament oral reposait principalement sur des essais cliniques de phase I et de phase II portant sur 500 patients atteints de LMC PH-positifs qui ne répondaient pas ou étaient intolérants à l'imatinib, y compris différents groupes aux stades chronique, accéléré et aigu. Selon les données de l'essai clinique de Pfizer, un tiers des patients précédemment traités par l'imatinib seul ont obtenu une rémission cytogénétique majeure après 24 semaines de prise de Bosutinib (500 mg une fois par jour). Chez les patients ayant reçu de l'imatinib et un autre inhibiteur de la tyrosine kinase (dasatinib, Sprycel), 27 % ont obtenu une rémission cytogénétique majeure. Les taux de réponse ont continué d'augmenter dans les deux groupes après 24 semaines ou plus de traitement, a déclaré Pfizer. Pfizer note que seulement 4 pour cent des patients atteints d'une maladie chronique progressent vers un stade avancé ou aigu après avoir pris du Besutinib. Les effets secondaires de grade 3 ou 4 comprennent la thrombocytopénie (26 %), la neutropénie (11 %), la diarrhée (9 %), l'anémie (9 %) et les éruptions cutanées (8 %).
Bosutris (Bosutinib) Le bossutinib a été initialement développé par Pfizer et a été approuvé pour la première fois aux États-Unis en septembre 2012 pour une utilisation chez les adultes atteints de LMC Ph+ qui ont eu des antécédents de résistance ou d'intolérance au traitement à des stades chroniques, accélérés ou aigus. . BOSULIF est le premier médicament de Pfizer à traiter les tumeurs hématologiques et constitue une option thérapeutique importante pour les patients atteints de LMC Ph+ présentant des antécédents de résistance ou d'intolérance aux médicaments. Cette indication élargie pourrait potentiellement avoir un impact encore plus important sur la vie des patients atteints de leucémie myéloïde chronique.
Le 13 juillet 2020, la société indienne Mylan Pharmaceutical a inauguré le lancement commercial du Bosutinib (Bosutinib/Bosutinib/Bosutinib), un générique générique du Bosutris. Une version générique du Bosutris de Mylan coûte environ 25 % de moins que le Bosulif original de Pfizer. (Aussi : Upjohn, la branche génériques de Pfizer, fusionnera avec Mylan cette année pour créer Viatris, la plus grande société de génériques au monde, qui sera achevée au quatrième trimestre 2020.)




