
- English
- Español
- Português
- русский
- Français
- 日本語
- Deutsch
- tiếng Việt
- Italiano
- Nederlands
- ภาษาไทย
- Polski
- 한국어
- Svenska
- magyar
- Malay
- বাংলা ভাষার
- Dansk
- Suomi
- हिन्दी
- Pilipino
- Türkçe
- Gaeilge
- العربية
- Indonesia
- Norsk
- تمل
- český
- ελληνικά
- український
- Javanese
- فارسی
- தமிழ்
- తెలుగు
- नेपाली
- Burmese
- български
- ລາວ
- Latine
- Қазақша
- Euskal
- Azərbaycan
- Slovenský jazyk
- Македонски
- Lietuvos
- Eesti Keel
- Română
- Slovenski
- मराठी
- Srpski језик
Fumarate de giltéritinib
2023-12-02
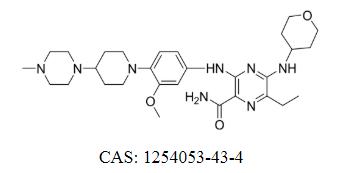
Fumarate de giltéritinib Cas : 1254053-43-4
1. Origines
Les médicaments ciblés contre la maladie de Gillette (Gilteritinib) destinés aux patients atteints de leucémie myéloïde aiguë vivent plus longtemps, comme l'indique une publication récente dans le New England Journal of Medicine d'un vaste essai clinique. Xospata), peut améliorer dans une certaine mesure le taux de survie des patients atteints de leucémie myéloïde aiguë (LAM).
Les résultats du nouvel essai sont encourageants. Les 371 patients inclus dans l'essai étaient des patients atteints de LMA présentant une mutation spécifique du gène FLT3 qui avaient déjà été traités mais qui ont ensuite rechuté ou n'ont pas répondu au traitement (récidivant/réfractaire). Ils ont été assignés au hasard soit au traitement par Gilteritinib, soit à une chimiothérapie standard.
Les résultats ont montré que les patients traités pour avoir accepté Gillett, Gilteritinib non seulement vivent plus longtemps que les patients sous chimiothérapie (la durée médiane de survie globale était de 9,3 mois à 5,6 mois), et sont plus susceptibles d'obtenir une rémission complète, le nombre de globules blancs étant revenu à un niveau normal. en totalité ou en partie (patients traités par Gilteritinib (34%), 15%) chez les patients sous chimiothérapie.
2. Présentation
Le fumarate de giltéritinib, développé par Astellas, a été approuvé par l'Agence japonaise d'intégration des dispositifs et dispositifs médicaux pharmaceutiques (PMDA) le 21 septembre 2018, puis par la Food and Drug Administration (FDA) des États-Unis le 28 novembre 2018, et par l'Agence européenne des médicaments. (EMA) le 24 octobre 2019 sous la dénomination commerciale Xospata®. Le giltéritinib a reçu le statut de médicament accéléré et orphelin de la FDA.
Le fumarate de giltéritinib est un inhibiteur de FLT3/AXL et Xospata® est approuvé pour le traitement de la leucémie myéloïde aiguë récurrente ou réfractaire avec une mutation FLT3 positive.
Xospata® est un comprimé oral contenant 40 mg de Gilteritinib. La dose recommandée est de 120 mg une fois par jour. Augmentez ou diminuez la dose en fonction de l'état du patient, mais ne doit pas dépasser 200 mg par jour.
3. Point cible
AXE ; FLT3
4. Mécanisme d'action
Inhibiteurs des récepteurs AXL ; Inhibiteurs de FLT3
5. Indications
Leucémie myéloïde aiguë
6. Étape de développement
Agréé à la commercialisation le 21 septembre 2018
7. Entreprise de R&D
Astellas
8. Voie de synthèse
8.1. L'itinéraire d'origine
8.2. Notre itinéraire (optimisé) - Meilleure stabilité et rendement plus élevé
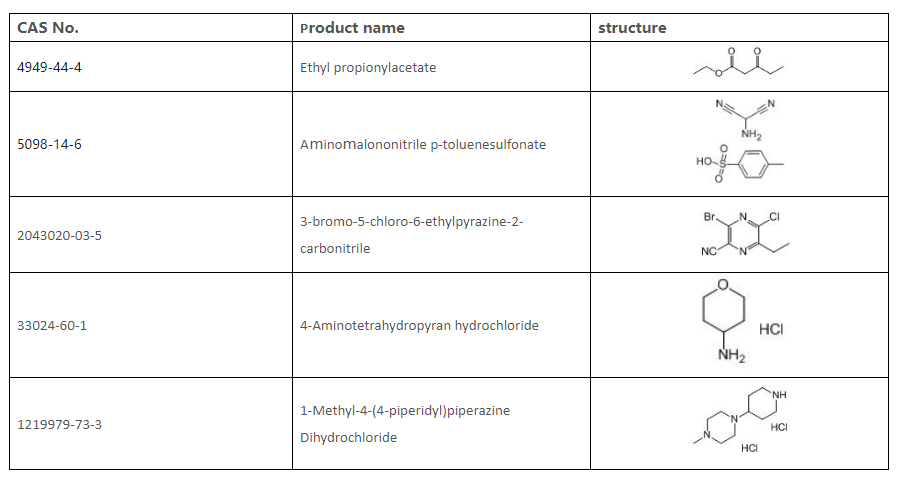
8.3. Ros de KSM [CAS 2043020-03-5]
8.4. Bref processus de fabrication [CAS 2043020-03-5]
Étape 1:
À une suspension de NaOH, on a ajouté du 3-oxopentanoate d'éthyle en une portion, puis le mélange réactionnel a été agité à température ambiante. Une solution de NaNO2 dans l’eau a été ajoutée, puis du H2SO4 a été ajouté goutte à goutte. Une solution de NaOH a été ajoutée goutte à goutte et le mélange résultant a été extrait avec du MTBE. Les couches organiques combinées ont été lavées avec de la saumure, séchées sur Na2S04, filtrées et concentrées pour donner le produit (E)-2-oxobutanal oxime.
Étape 2:
Une suspension d'oxime de (E)-2-oxobutanal et d'acide aminomalononitrile p-toluènesulfonique dans de l'IPA) a été agitée à température ambiante sous argon. Après vérification par CCM, le mélange réactionnel a été filtré, le gâteau a été lavé avec de l'IPA et de l'eau et séché pour donner du 2-amino-3-cyano-5-éthylpyrazine-1-oxyde.
Étape 3:
À une suspension de 2-amino-3-cyano-5-éthylpyrazine-1-oxyde dans du DMF anhydre, du POCl3 a été ajouté à 0 °C. Le mélange résultant a été agité à 80°C. Après avoir été vérifié par CCM, le mélange réactionnel a été ajouté lentement dans de la glace/eau et extrait avec du MTBE. Les couches organiques combinées ont été lavées avec de la saumure, séchées sur Na2S04, filtrées et concentrées pour donner du 3-amino-5-chloro-6-éthylpyrazine-2-carbonitrile.
Étape 4:
À une suspension de t-BuONO et de CuBr2 dans du DMF, on a ajouté goutte à goutte une solution de 3-amino-5-chloro-6-éthylpyrazine-2-carbonitrile dans du DMF. Après avoir été vérifié par CCM, le mélange réactionnel a été refroidi à température ambiante, puis versé dans de la glace/eau, extrait avec du MTBE. Les couches organiques combinées ont été lavées avec de la saumure, séchées sur Na2S04, filtrées et concentrées pour donner un produit brut qui a été purifié par chromatographie pour donner du 3-bromo-5-chloro-6-éthylpyrazine-2-carbonitrile.
9. Liste des intermédiaires que nous pouvons fournir
Sandoo Pharmaceutica est un fabricant professionnel d'intermédiaires pharmaceutiques. Nous fournissons du fumarate de giltéritinib Cas : 1254053-43-4 de bonne qualité. Bienvenue et nous attendons votre demande avec impatience !




